Schutz von Spendern und Qualitätssicherung unserer Blutprodukte
Der Schutz unserer Blutspender und die Qualität der von uns hergestellten Produkte (und damit auch der Schutz der Patienten) spielt eine zentrale Rolle in der Arbeit des DRK-Blutspendienstes Baden-Württemberg – Hessen. Durch ein engmaschiges Netz an aufeinander abgestimmten Maßnahmen und innovativen Forschungsprojekten gewährleisten wir ein ausgesprochen hohes Sicherheitsniveau.
- Freiwillig und unentgeltlich spenden: Unsere Vollblutspenden werden nur von freiwilligen Blutspendern entnommen. Kein Blutspender wird durch einen finanziellen Anreiz zur Spende motiviert, denn jede Vollblutspende ist unentgeltlich.
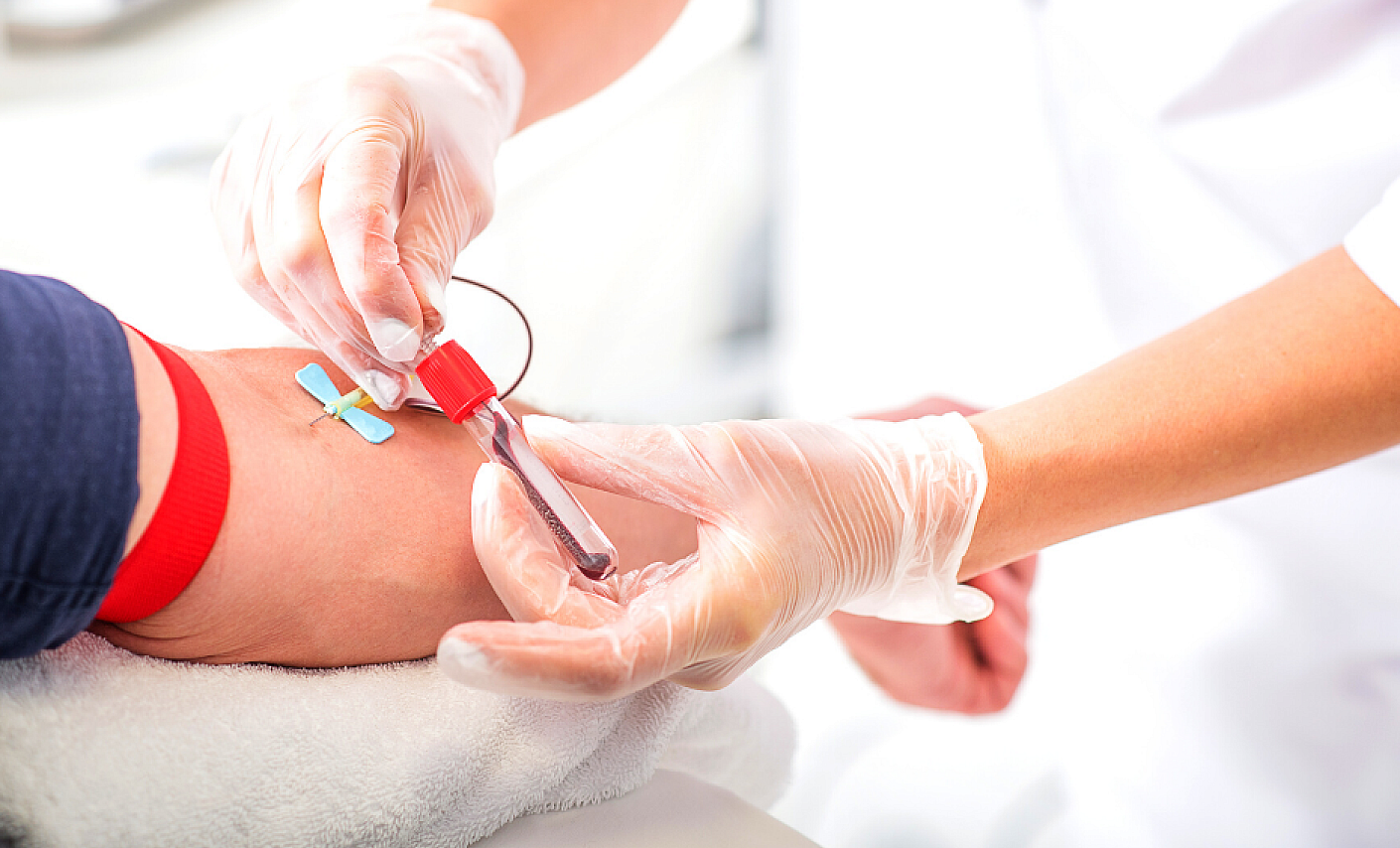
- Das diagnostische Fenster erkennen: Wir achten in besonderem Maße auf die Gesundheit der Spendewilligen zum Spendezeitpunkt. Besonders wichtig dabei: das „diagnostische Fenster“ – also der Zeitraum zwischen einer möglichen Infektion mit einem Erreger und dessen Nachweisbarkeit in einem Labortest. Durch gezielte und detaillierte Fragen vor einer möglichen Spende filtern wir Personen heraus, die sich möglicherweise im diagnostischen Fenster befinden und deshalb nicht zur Spende zugelassen werden dürfen. Diese Daten werden natürlich streng vertraulich und unter Beachtung der Würde des Spenders behandelt.
- Erreger im Labor identifizieren: Durch die Anwendung hochsensibler Laborverfahren können wir das diagnostische Fenster weiter verkleinern. Unser Blutspendedienst testet jede Blutspende mit modernsten molekularbiologischen Methoden (PCR) nach Vorschrift auf die Erreger HIV, HCV, HBV, HAV und Parvo-Virus-B19.
Alle Schritte der Herstellung und Testung der Blutprodukte werden durch ein leistungsfähiges EDV-System unterstützt. Auch das trägt zu der sehr hohen Sicherheit der Blutprodukte bei.
Hohe Transparenz durch unsere sachkundigen Experten
Für Anfragen zum Thema Medizinproduktesicherheit steht dir beim DRK-Blutspendedienst Baden-Württemberg – Hessen der Beauftragte für Medizinproduktsicherheit zur Verfügung. Damit werden die Vorgaben der aktuellen Medizinprodukte-Betreiberverordnung (MPBetreibV) umgesetzt. In §6 ist geregelt, dass alle Gesundheitseinrichtungen mit regelmäßig mehr als 20 Beschäftigen eine sachkundige, zuverlässige Person mit medizinischer, naturwissenschaftlicher, pflegerischer, pharmazeutischer oder technischer Ausbildung als Beauftragten für Medizinproduktesicherheit benennen müssen.
Zu den Aufgaben des Beauftragten für Medizinproduktesicherheit zählen:
- Kontakt für Anwender, Behörden, Hersteller, Vertreiber im Zusammenhang mit Meldungen über Risiken von Medizinprodukten sowie bei der Umsetzung der notwendigen korrektiven Maßnahmen
- Koordinierung der Rückrufmaßnahmen der Hersteller in Gesundheitseinrichtungen
- Prüfung der Informationen der Bundesoberbehörden oder von Herstellern über Medizinprodukte-Risiken und gezielte interne Weiterleitung